多発性骨髄腫の治療
多発性骨髄腫は、治療により奏効が得られても、再発を繰り返す血液疾患であり、難治性が高いとされています。
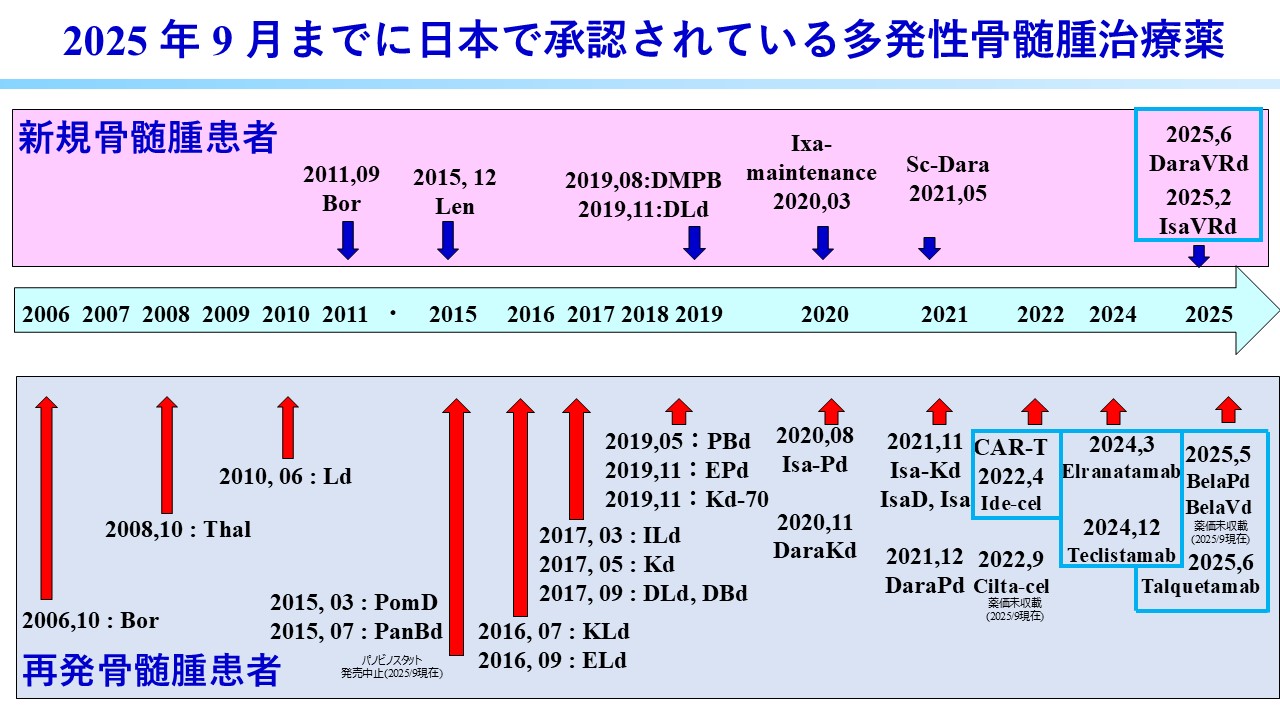
一方で、多発性骨髄腫に対する新薬の開発は目覚ましく、2006年にボルテゾミブが承認されて以来、プロテアソーム阻害薬(PIs)、免疫調節薬(IMiDs)、モノクローナル抗体などが次々と開発され、多くの新薬が使用可能となりました(表1)。
(図1)
しかし、仮に3剤併用療法を2~3レジメン使用してしまった場合、多くの薬剤に耐性を示し、有効な治療選択肢が限られてしまうのが現実です。このような患者に対する治療薬の開発が急務でした。
近年、最も注目されている治療の開発は、B細胞成熟抗原(BCMA)を標的とした治療法です。BCMAを標的とするキメラ抗原受容体T細胞療法(CAR-T細胞療法)は2022年1月に日本でも承認され(アベクマ®)、BCMAを標的とする二重特異性抗体も2024年に承認されました(エルレフィオ®、テクベイリ®)。これらの治療薬は非常に有効ですが、プロテアソーム阻害薬(PIs)、免疫調節薬(IMiDs)、抗CD38抗体の3種類の薬剤を使用した後でないと保険適用がありません。
現在、治験ではCAR-T細胞療法や二重特異性抗体を初発の患者に投与する試みが行われています。これらの治験により、初発の患者においてCAR-T細胞療法や二重特異性抗体がこれまでの治療法より有効であることが証明されれば、多発性骨髄腫を長期間コントロール可能となり、一部の症例では治癒が得られるのではないかと期待されています。
2025年にはさらに治療法の選択肢が増える見込みです。初発の患者に対しては、これまで3剤併用療法が基本でしたが(移植適応患者にはVRd療法、移植非適応患者にはダラキューロ®+レブラミド®+レナデックス®療法)、2025年に4剤併用療法が承認されました。サークリサ®(Isa)+ベルケード®+レナリドマイド®+レナデックス®(VRd)療法はIMROZ試験で、これまでのVRd療法と比較して無増悪生存期間が延長し、微小残存病変陰性達成率と微小残存病変陰性継続率が改善されました。ダラキューロ®(Dara)+VRd療法はCEPHEUS試験でIMROZ試験と同様の有効性が報告されています。これらの4剤併用療法を移植適応患者や移植非適応患者に初回治療として使用することで、長期間の病勢コントロールが可能になると期待されています。
さらに、BCMAではなくGPRC5Dを標的とした二重特異性抗体であるタービー®が2025年6月に承認されました。BCMAを標的とした治療後にも一定の効果が報告されています。その他にも、まだ薬価はついていませんが、BCMAを標的とした抗体に抗がん剤を結合させたADC製剤であるブーレンレップ®も承認され、治療の選択肢がさらに増えました。
今後期待される治療として、様々なCAR-T細胞療法の治験が進行中です。具体的には、BCMAの結合部位がヒト化されたもの、GPRC5Dを標的としたもの、CD19とBCMAの二つの抗原を標的としたものなどがあります。さらに、2025年6月に開催されたヨーロッパ血液学会で発表された演題の中には、真の髄外腫瘤を有する骨髄腫患者に対してBCMA標的二重特異性抗体とGPRC5D標的二重特異性抗体を併用する試験や、BCMA、GPRC5DとCD3に結合できる三重特異性抗体の試験結果が注目されました。
多発性骨髄腫治療に関しては、当センターではキメラ抗原受容体T細胞(CAR-T)療法、二重特性抗体療法、標準化学療法、自家末梢血幹細胞移植、同種移植の他にも多くの臨床治験が行われております。特に新規CAR-T療法や、新規二重特性抗体療法、または新規併用療法などの免疫細胞療法の多くの治験が行われており、有効性が報告されております。治験内容を知りたい方は、日本赤十字社医療センターのホームページから「治験・臨床研究」⇒「治験」⇒「一般の皆様へ」⇒「
治験審査委員会議事概要」にアクセスすると、治験内容がダウンロードできます。治験は登録必要患者数の登録が終了すると登録枠がなくなります。また新しい治験も開始されますので、実際どのような治験があるかは紹介状を持参して受診していただくと、登録可能な治験があるか正確に把握できます。
治療効果判定法にも変化が生じ、stringent CRは通過点であり、stringent CRよりさらに深いレベルまで骨髄腫細胞を減らした微小残存病変(MRD)陰性の状態を目指した治療を検討する時代に至っています。MRD測定法としてはMFC・NGSなどがありますが、骨髄腫病巣の不均一性から、全身MRI やPET -CT 等の画像も含めた総合診断が必要です。特に若年者では新規薬剤を上手に組み合わせた併用療法を行うことでMRD陰性を目指し、多発性骨髄腫を“延命”から“治癒”へと変えていくことが目標となります。
ALアミロイドーシス
AL(Amyloid-Light chain)アミロイドーシスとは、異常な形質細胞より産生されたモノクローナルな免疫グロブリン軽鎖が立体構造異常を引き起こし、アミロイド蛋白として全身の臓器に沈着し、進行性の臓器障害をきたす疾患です。ALアミロイドーシスは、症状が非特異的であり、多臓器にわたるため、診断が遅れやすい上に病勢の進行もはやいことが特徴です。不可逆的な臓器障害が進行する前に迅速かつ正確に診断して治療を開始する必要があり、難病とされています。多発性骨髄腫などに続発する続発性ALアミロイドーシスと骨髄腫などの基礎疾患を伴わない原発性ALアミロイドーシスに分類されます。
ALアミロイドーシスの治療の要点ポイントはアミロイド蛋白の産生の原因となるFLCの産生を早急に抑制し、臓器障害の進行を防ぐことです。というのも、診断時のstageが予後不良であっても血液学的奏功が得られた場合は予後が良好であることが示唆されているからです。そのためにフリーライトチェーン(FLC、アミロイドのもとになるたんぱく質、κまたはλ)を産生する異常な形質細胞を早急に消失させる必要があります。移植適応か非適応かが治療選択の分かれ目となりますが、現状は自家移植後の無増悪生存期間を延長させるためにも、移植適応かどうかに関わらず、診断後の標準療法はDara-CyBorD(ダラツムマブ+シクロフォスファミド+ボルテゾミブ+デキサメタゾン)療法とされています。ANDROMEDA試験ではDara-CyBorD VS CyBorDでCR率が53.5% VS 18.1%と有意な差がありました。臓器奏功については、心臓41.5%対22%、腎臓53.0%対27%でDara-CyBorD群が優れていました。一方でPerformance status(PS)不良例(PS≧3)や高度の心不全・腎不全例では治療の安全性や有効性に課題があります。また、ANDROMEDA試験にはCardiac stage IIIbの患者は登録されていないため、実臨床では高度の心アミロイドーシス患者に対しボルテゾミブを減量(0.7〜1.0 mg/m²)または省いたレジメンも施行されています。
ALアミロイドーシスの治験に関しても、日本で実施される治験には当センターは積極的に参加しております。
英文論文
当センターの医師が共著になっている2021年から2025年の主要な英文論文を紹介します。
1 N Engl J Med. 2025 May 8;392(18):1777-1788.
2 Nat Med. 2025 Apr;31(4):1195-1202.
3 J Clin Oncol. 2025 Aug;43(22):2527-2537.
4 Sci Rep. 2025 Apr 25;15(1):14523.
5 Haematologica. 2025 Sep 1;110(9):2160-2170.
6 Lancet Haematol. 2025 Aug;12(8):e574-e587.
7 Clin Hematol Int. 2025 Apr 11;7(2):1-19.
8 Transpl Infect Dis. 2025 Jul-Aug;27(4):e70040.
9 Lancet Oncol. 2025 May;26(5):596-608.
10 Int J Hematol. 2025 Apr;121(4):476-482.
11 Ann Hematol. 2025 Apr;104(4):2337-2350.
12 Int J Hematol. 2025 Sep;122(3):421-433.
13 Hematol Oncol. 2025 Sep;43(5):e70129.
14 Int J Hematol. 2025 Feb;121(2):222-231.
15 Acta Haematol. 2025;148(1):85-90.
16 N Engl J Med. 2024;391:1597.
17 Blood. 2024 ;143:2401-2413.
18 PLoS One. 2024 Sep 30;19(9):e0310333.
19 Lancet Haematol. 2024 Oct;11(10):e741-e750.